ESTERES
PROPIEDADES FÍSICAS:
Al tratarse de compuestos moleculares (líquidos volátiles o
sólidos) sus propiedades físicas más representativas son:
Aislantes eléctricos en
fusión y en disolución.
Bajo temperatura de fusión y
ebullición que crece con la masa molar. Las propiedades físicas y químicas de
los ésteres de bajo peso molecular corresponden, en general, a una combinación
de las propiedades de los dos grupos. Al aumentar el peso molecular, la parte
de hidrocarburo de la molécula tiene un efecto preponderante sobre las
funciones oxigenadas, razón por la cual los ésteres superiores son ceras
sólidas, blandas e insolubles en agua.
Según la longitud de la
cadena hidrocarbonada serán más o menos solubles en agua y más o menos solubles
en disolventes orgánicos (hexano, éter, benceno, acetona…)
PROPIEDADES QUÍMICAS:
- En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados.La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
Muchos ésteres tienen un aroma característico, lo que hace
que se utilicen ampliamente como sabores y fragancias artificiales. Por
ejemplo:
Combinando anhídridos con alcoholes.
Usos de los ésteres:
La mejor aplicación es utilizarlo en esencias para dulces y
bebidas. Otros para preparar perfumes. Otros como antisépticos, como el cloruro
de etilo.
Los ésteres son empleados en muchos y variados campos del
comercio y de la industria, como los siguientes:
Disolventes
Plastificantes
Los ésteres de bajo peso molecular son líquidos y se
acostumbran a utilizar como disolventes, especialmente los acetatos de los
alcoholes metílico, etílico y butílico.
fragancias
El salicilato de metilo se emplea principalmente como
agente aromatizante y posee la ventaja de que se absorbe a través de la piel.
Una vez absorbido, el salicilato de metilo puede hidrolizarse a ácido
salicílico, el cual actúa como analgésico. Este producto puede extraerse de
varias plantas medicinales capaces de aliviar el dolor.
|
|
- Aditivos Alimentarios
- Estos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.
- Productos Farmacéuticos
Productos de uso tan frecuente como los analgésicos se fabrican con ésteres.
- Repelentes de insecto
- Todos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres.
¿Para cuáles
condiciones o enfermedades se prescribe este medicamento?
Los ésteres etílicos del ácido omega 3 se utilizan junto con
cambios en el estilo de vida (dieta, adelgazamiento y ejercicio) para reducir
la cantidad de triglicéridos (sustancias grasas) en la sangre. Los ésteres
etílicos del ácido omega 3 pertenecen a una clase de medicamentos denominados
agentes antilipémicos o reguladores de los lípidos. Es posible que los ésteres
etílicos del ácido omega 3 actúen al reducir la cantidad de triglicéridos y
otras grasas que se producen en el hígado.
otro medicamento :
La presente invención se refiere al uso de los ésteres de
ácidos 1,4-dihidropiridin-3,5-dicarboxílicos, conocidos en parte, de fórmula
general (i): en la cual a, r1-r3 tienen el significado mencionadoLa presente
invención se refiere al uso de los ésteres de ácidos
1,4-dihidropiridin-3,5-dicarboxílicos, conocidos en parte, de fórmula general
(i): en la cual a, r1-r3 tienen el significado mencionado en la descripción,
como medicamento, especialmente para el tratamiento del sistema nervioso central,
y a nuevas sustancias activas escogidas.
riesgos :
Omacor, cápsula blanda
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Por cápsula:
Ésteres etílicos de ácidos grasos omega-3 al 90% ............................................................ 1000 mg
Conteniendo 840 mg de ácido eicosapentanóico (EPA) etil éster (460 mg) y ácido docosahexanóico
(DHA) etil éster (380 mg).
Lista completa de excipientes, ver la sección 6.1.
Advertencias y precauciones especiales de empleo
Advertencias
Debido al aumento moderado del tiempo de hemorragia (con la dosis elevada, es decir, 4 cápsulas),
debe monitorizarse a los pacientes que reciban tratamiento anticoagulante y ha de ajustarse la dosis
de anticoagulante en caso necesario (véase la sección 4.5 “Interacción con otros medicamentos y
otras formas de interacción”). El uso de este medicamento no excluye la necesidad de vigilancia,
generalmente necesaria en esta clase de pacientes.
Debe considerarse el aumento del tiempo de hemorragia en pacientes con un alto riesgo de
hemorragia (a causa de traumatismo grave, cirugía, etc.).
A falta de datos sobre la eficacia y seguridad, no se recomienda el uso de este
medicamento en niños.
Omacor no está indicado en hipertrigliceridemia exógena (tipo 1 hiperquilomicronemia).
Sólo se dispone de experiencia limitada sobre la hipertrigliceridemia endógena secundaria
(especialmente diabetes no controlada).
Precaución especial
En pacientes con alteración hepática (en particular en los que reciban la dosis elevada, es decir, 4
cápsulas) es necesario una monitorización regular de la función hepática (AST y ALT).
compuestos
Un éster es un compuesto formado junto con agua por la
reacción de un ácido y un alcohol. Puesto que este proceso es análogo a la
neutralización de un ácido (R) por una base en la formación de una sal,
antiguamente los ésteres eran denominados sales etéreas. Este término es
incorrecto porque los ésteres, a diferencia de las sales, no se ionizan en
disolución.
En química los ésteres son compuestos orgánicos en los
cuales un grupo orgánico reemplaza a un átomo de hidrógeno o más de uno, en un
ácido oxigenado. Un ácido oxigenado es un ácido cuyas moléculas poseen un grupo
OH– desde el cual el hidrógeno (H) puede disociarse como un ión protón (H+).
bibliográfica :
.png)
.png)
.jpg)

.jpg)










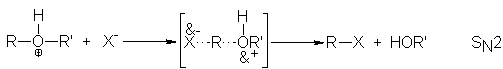















.png)













